Orexo a déposé une demande d’autorisation auprès de la FDA pour une formulation nasale de naloxone à forte dose basée sur sa technologie d’administration de…
View More Orexo, en s’appuyant sur la technologie d’administration des médicaments, cherche à obtenir l’approbation de la FDA pour un médicament de secours nasal à forte dose pour les opioïdes.Catégorie : Médicaments
Approbations de médicaments en 2022 : Après le fiasco d’Aduhelm, les approbations de la FDA tombent à 37 %.
Après une moyenne de 51 autorisations de nouveaux médicaments par an depuis 2017, la FDA n’en a enregistré que 37 en 2022. L’organisme de réglementation…
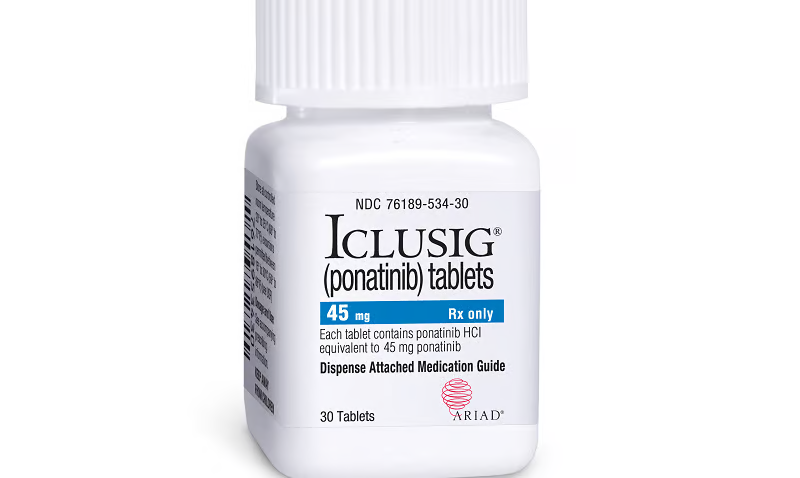
View More Approbations de médicaments en 2022 : Après le fiasco d’Aduhelm, les approbations de la FDA tombent à 37 %.L’Agence européenne des médicaments recommande de modifier l’utilisation du médicament contre la leucémie Iclusig (ponatinib) afin de minimiser le risque de caillots sanguins.
L’Agence européenne des médicaments recommande de modifier l’utilisation du médicament contre la leucémie Iclusig (ponatinib) afin de minimiser le risque de caillots sanguins. Le Comité…
View More L’Agence européenne des médicaments recommande de modifier l’utilisation du médicament contre la leucémie Iclusig (ponatinib) afin de minimiser le risque de caillots sanguins.Infliximab (Risque potentiel de bursite)
Arabie Saoudite. La SFDA a publié un signal de sécurité concernant la bursite associée à l’utilisation de l’infliximab.L’infliximab est un anticorps monoclonal qui inhibe la…
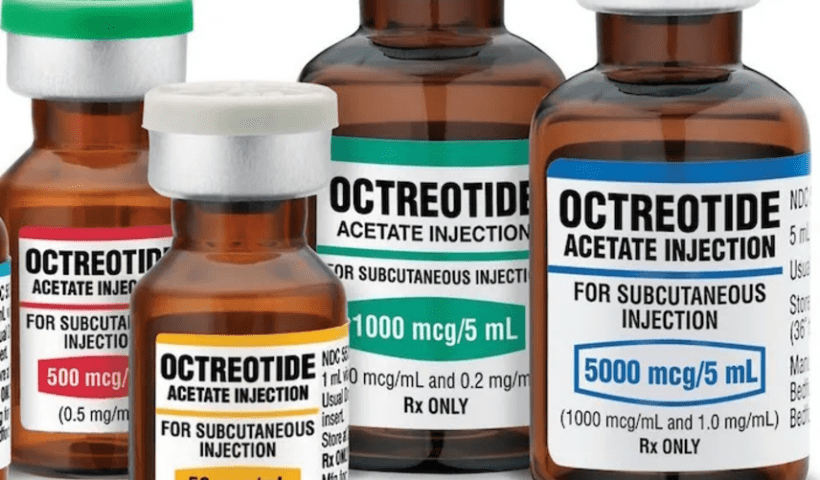
View More Infliximab (Risque potentiel de bursite)Octréotide (Risque de bloc auriculo-ventriculaire).
Australie. La TGA a annoncé que la perfusion intraveineuse d’octréotide, qui est utilisée de manière non autorisée en Australie, est liée au risque de bloc…
View More Octréotide (Risque de bloc auriculo-ventriculaire).Le Lynparza d’AstraZeneca et de Merck sera présenté à la FDA dans le cadre d’un appel d’offres pour le cancer de la prostate, alors que la surveillance des PARP s’intensifie.
Après plusieurs retraits du marché, l’examen minutieux par la FDA des médicaments anticancéreux de la classe des inhibiteurs de la PARP ne semble pas s’atténuer.…
View More Le Lynparza d’AstraZeneca et de Merck sera présenté à la FDA dans le cadre d’un appel d’offres pour le cancer de la prostate, alors que la surveillance des PARP s’intensifie.J&J obtient le feu vert de l’UE pour le combo PARP Akeega dans le cancer de la prostate, mais seulement chez certains patients.
Johnson & Johnson (J&J) démarre la course aux inhibiteurs PARP dans le cancer de la prostate en position de faiblesse. Les évaluateurs de l’Agence européenne…
View More J&J obtient le feu vert de l’UE pour le combo PARP Akeega dans le cancer de la prostate, mais seulement chez certains patients.Des nanoparticules maximisent l’effet STING d’un médicament anticancéreux lors de tests précliniques
Les chercheurs se sont tournés vers les nanoparticules d’administration de médicaments pour maximiser le STING anticancéreux d’une molécule, ce qui laisse entrevoir un moyen possible…
View More Des nanoparticules maximisent l’effet STING d’un médicament anticancéreux lors de tests précliniquesLa filiale de Bristol Myers à l’origine du produit phare contre le cancer, Abraxane, a reçu une lettre d’avertissement de la FDA.
La FDA prend directement en compte les plaintes concernant les problèmes de fabrication d’une filiale de Bristol Myers Squibb. Dans une lettre d’avertissement datée du…
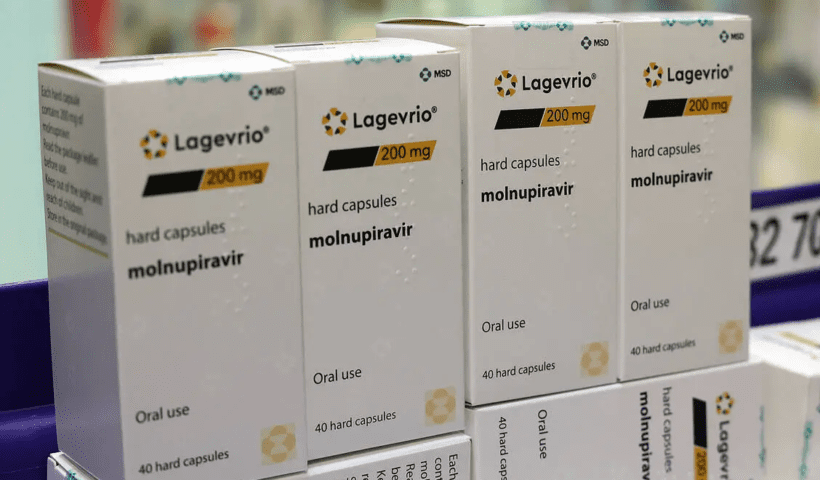
View More La filiale de Bristol Myers à l’origine du produit phare contre le cancer, Abraxane, a reçu une lettre d’avertissement de la FDA.Lagevrio, la pilule COVID de Merck, subit un nouveau rejet de la part du régulateur de l’UE
Les coups ne cessent de pleuvoir pour Lagevrio, la pilule COVID-19 de Merck et Ridgeback Biotherapeutics. Trois jours à peine après que les sociétés ont…
View More Lagevrio, la pilule COVID de Merck, subit un nouveau rejet de la part du régulateur de l’UE